La promesa de suplementos como el colágeno —hidrolizado, marino o revestido de cualquier otro epíteto ornamental que se le quiera añadir— está limitada por problemas recurrentes de sesgo y de diseño, cuando no por conflictos de interés[1] (y, en no pocas ocasiones, desconocimiento), factores que a menudo convergen en una turbia amalgama.
Gran parte de la literatura que avala sus presuntas bondades adolece de una inquietante circularidad: investigaciones sufragadas por la propia industria, ejecutadas sobre muestras exiguas o carentes de controles adecuados; en otras, interpretaciones sesgadas de los resultados. El balance final oscila entre la irrelevancia estadística y un potente efecto placebo, alimentado por la expectativa del paciente. A ello se suma la abundancia de ensayos de corta duración, con heterogeneidad de formulaciones y, en ocasiones, sin grupos de control (placebo) apropiados; las conclusiones derivadas de trabajos con tales limitaciones no deben extrapolarse a la población general.
En ese contexto, no es raro que algunos estudios no muestren diferencias significativas en dolor o función articular frente al placebo —vocablo latino cuyo significado es “yo complaceré” (Valero, 2025b)—; y cuando el usuario percibe alivio, una fracción del mismo responda meramente a la sugestión y/o a otras estrategias adoptadas. En deportistas, el mejor nivel de síntesis disponible no respalda la promesa comercial de “tendones más fuertes” por el mero hecho de suplementar: no se observan mejoras consistentes en fuerza y se repite, con frecuencia, un patrón de financiación industrial en los estudios primarios (Kirmse et al., 2024; Bischof et al., 2024).
En ese contexto, no es raro que algunos estudios no muestren diferencias significativas en dolor o función articular frente a placebo —vocablo latino cuyo significado es “yo complaceré” (Valero, 2025b)—, y cuando el usuario percibe alivio, una fracción puede explicarse por expectativas y efecto placebo. En el ámbito deportivo, la mejor evidencia acumulada no respalda la promesa comercial de “articulaciones más fuertes” por el mero hecho de suplementar, con ausencia de mejoras consistentes en fuerza y con un patrón frecuente de financiación industrial en estudios primarios (Kirmse et al., 2024; Bischof et al., 2024).
Así, lo que el marketing presenta como una verdad sólida es, en realidad, un corpus de evidencia sesgado y metodológicamente inconsistente, incapaz de sostener ante la comunidad académica la supuesta superioridad del suplemento frente a la sugestión o el azar.
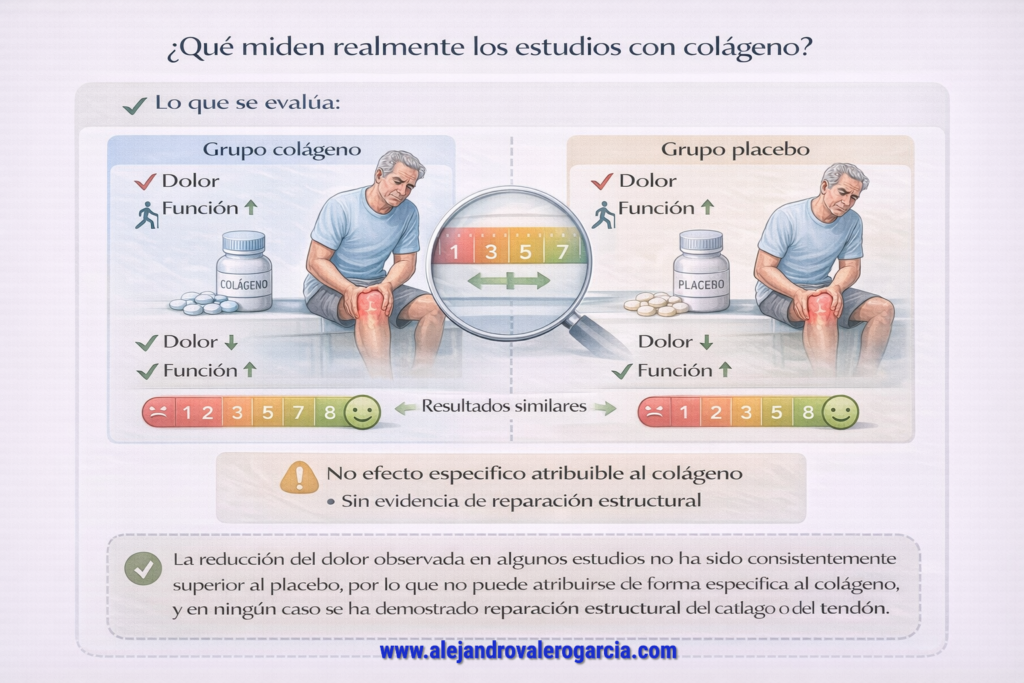
Desde una óptica fisiológica, la narrativa comercial tropieza con la dura realidad biológica: la ingesta de colágeno no garantiza que los péptidos “se dirijan” de forma específica, con brújula propia, a reparar tendones o cartílagos. Las revisiones sistemáticas más recientes (citadas en estos dos párrafos) desmantelan la idea de una mejora estructural en deportistas y, en el caso de la osteoartritis, reducen su impacto a un modesto alivio sintomático —paliativo en el mejor de los casos, no regenerativo— que bien podría atribuirse, simplemente, a un aumento de la ingesta proteica total. No se han observado diferencias suficientemente relevantes frente al placebo como para aseverar responsablemente sus beneficios y, paralelamente, sí sabemos que aumentar la ingesta proteica se relaciona con beneficios estructurales.
La objeción fisiológica central no es la imposibilidad, sino el salto inferencial no demostrado. Que el colágeno se digiera en aminoácidos y pequeños péptidos no implica direccionamiento selectivo hacia cartílago o tendón, ni mejoras clínicamente relevantes en la integridad mecánica. Las revisiones que reportan cambios morfológicos o en biomarcadores subrayan que no está claro el mecanismo por el que se producirían esos cambios, así como la baja calidad de evidencia para atribuir propiedades “estructurales” (Bischof et al., 2024).
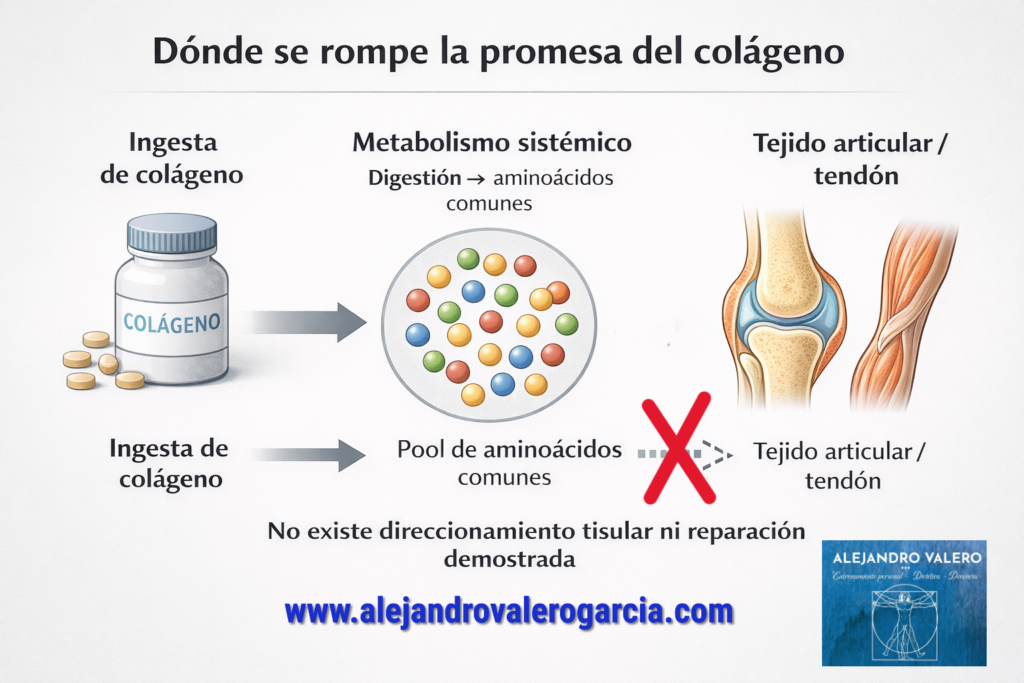
Estos productos de digestión se absorben en el intestino delgado, sobre todo, mediante transportadores específicos como PepT1[2]; y, en el adulto sano, la mayor parte de los péptidos que llegan a cruzar el epitelio se hidroliza dentro del enterocito antes de incorporarse a la circulación portal (Raymond & Morrow, 2023). La evidencia disponible indica, además, que la absorción significativa de péptidos intactos de mayor tamaño es limitada y no constituye una vía relevante de suministro tisular en condiciones fisiológicas normales, salvo en contextos inmunológicos muy concretos (Miner-Williams et al., 2014).
Mediante esta base fisiológica explicamos por qué no puede inferirse, a partir del simple consumo de colágeno, un efecto específico o selectivo suficiente sobre cartílago, tendones o articulaciones; cualquier afirmación en ese sentido exige una demostración clínica independiente mediante ensayos con desenlaces pertinentes y clínicamente relevantes. Desde el punto de vista de la fisiología digestiva, no existe un mecanismo por el cual una proteína dietética conserve su identidad estructural ni su “destino tisular” tras la ingestión. Las grandes obras de referencia en dietoterapia y nutrición clínica describen de forma consistente que todas las proteínas alimentarias, con independencia de su origen —incluido el colágeno—, se desnaturalizan y se hidrolizan progresivamente por la acción de la pepsina gástrica y de las proteasas pancreáticas, dando lugar a aminoácidos libres y a di- y tripéptidos. Es decir, que comer oreja de cerdo no incrementará el tamaño ni la función de nuestro pabellón auditivo, así como la ingesta de pechuga de pollo no mejorará nuestra caja torácica (aunque esta última, debido a su aporte proteico y, principalmente, el ejercicio físico y un patrón dietético adecuado, colaborará en crear pectorales más fuertes).
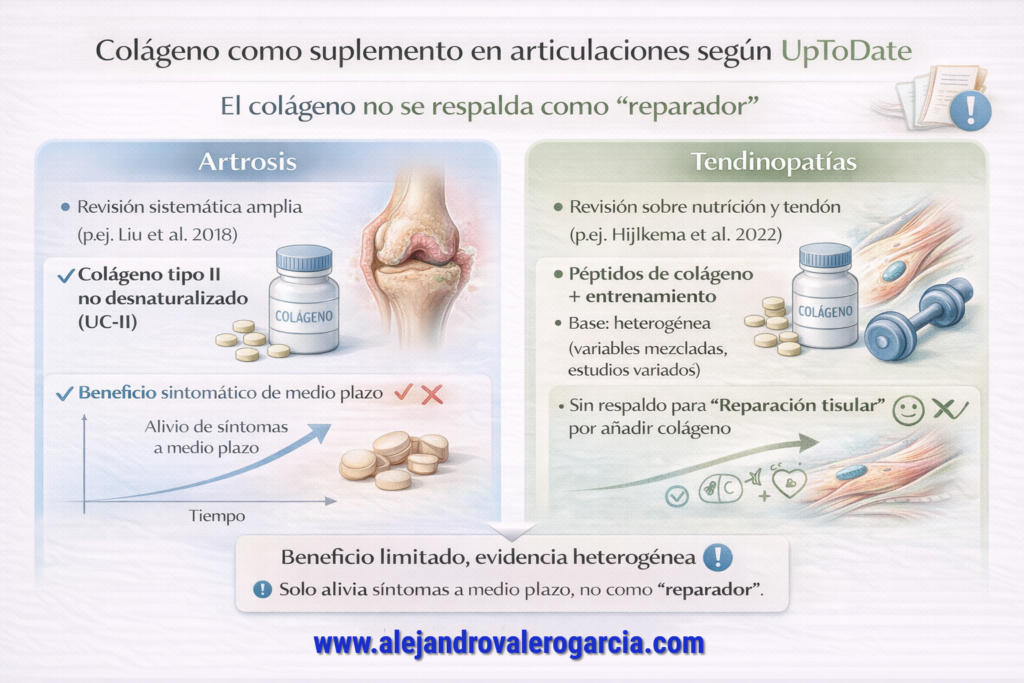
Si hablamos de artrosis, el panorama es más matizado: hay metaanálisis que encuentran efectos pequeños a moderados sobre dolor y función, pero eso no equivale a regeneración del cartílago ni a una modificación de la historia natural de la enfermedad. Por otro lado, cuando los estudios difieren tanto entre sí —y, además, no son inmunes a la influencia del patrocinio—, el beneficio promedio observado se vuelve menos fiable y se traslada peor a la práctica clínica (Liang et al., 2024; Simental-Mendía et al., 2025; Yuenyongviwat et al., 2025). En conjunto, lo defendible con la evidencia de 2024–2025 sobre esta proteína tan glorificada como incompleta es distinguir entre un posible beneficio sintomático modesto en artrosis y la ausencia de una base sólida para afirmar “reparación tisular” o “protección tendinosa” en población sana y activa; más aún cuando parte del efecto, si existe, podría estar mediado por el aumento de proteína total o por factores de dieta, entrenamiento y control de peso con respaldo más robusto. No en pocas ocasiones, es la modificación de hábitos y no un hábito en sí lo que conforma una mejora.
Paradigmas de la Reparación Tisular en 2025.
La rehabilitación de lesiones en tendones y ligamentos ha evolucionado hacia un modelo de precisión que prioriza la fisiología celular sobre el marketing de los nutracéuticos. Durante años, se promovió el uso de colágeno hidrolizado bajo la premisa de que esta proteína se incorporaba directamente al tejido dañado. Sin embargo, la ciencia actual desmiente esa “suplementación dirigida” —ya hemos visto que, una vez ingerido, el colágeno se descompone en el tracto digestivo del mismo modo que cualquier otra proteína—. Si la ingesta proteica total es suficiente[3], el cuerpo dispone de los precursores necesarios para sintetizar sus propios componentes estructurales sin necesidad de suplementos caros con escasa evidencia independiente (Jensen, 2025).
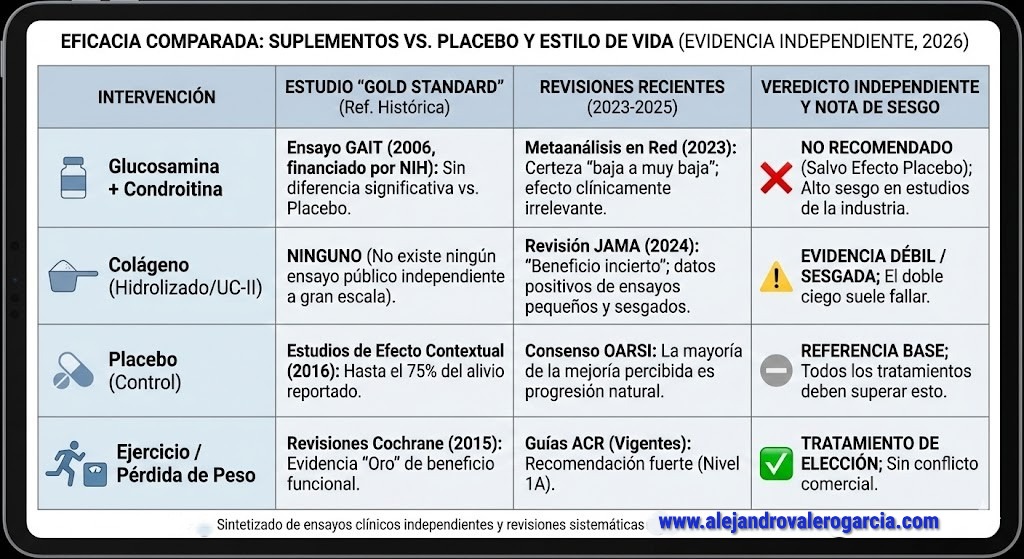
En una línea similar, los denominados «condroprotectores» como el sulfato de glucosamina y la condroitina han sido relegados a un plano de evidencia marginal. Estudios pivotales[4] y metaanálisis independientes de 2025 confirman que estas moléculas de gran tamaño sufren una degradación masiva antes de alcanzar el torrente sanguíneo, lo que se traduce en una biodisponibilidad ineficaz para la regeneración de la matriz extracelular (Puce et al., 2025). Ensayos clínicos de alta calidad —como el histórico estudio GAIT, del que hablaremos líneas más abajo— y revisiones sistemáticas posteriores muestran que su eficacia no supera al placebo en términos de reconstrucción estructural del tejido conectivo, quedando su uso, en todo caso, circunscrito a una posible modulación subjetiva del dolor en supuestos muy concretos (Wandel et al., 2010).
En cuanto a la gestión de la inflamación, la curcumina ha emergido como una alternativa natural para el manejo del dolor, pero su función es estrictamente reguladora y, probablemente, insuficiente. Al interferir en vías proinflamatorias como la NF-κB[5], puede auxiliar en la transición de la fase inflamatoria a la proliferativa de una lesión, evitando los efectos secundarios gástricos y metabólicos de los antiinflamatorios no esteroideos tradicionales (Buhrmann et al., 2017). No obstante, es imperativo comprender que la curcumina es un agente señalizador y no un material de construcción. Su presencia puede mejorar —en el mejor de los casos, levemente— el entorno biológico del tendón, pero por sí sola no posee capacidad para sintetizar nuevas fibras de colágeno (Li et al., 2025).
El pilar fundamental de la nutrición en la reparación tisular es, por tanto, la proteína total de alta calidad, no la fijación en suplementos —que, en ocasiones, incluso desplaza estrategias más eficaces por un exceso de confianza en ellos y falta de información respecto a tales estrategias—. Para optimizar la síntesis proteica y mitigar la atrofia muscular secundaria a la inmovilización, la evidencia de 2025 establece un rango de ingesta de entre 1,6 y 2,5 g/kg de peso corporal al día[6] (Mattioli, 2025). Esta cantidad asegura que el pool de aminoácidos en sangre sea constante y suficiente para cubrir tanto la demanda muscular como la del tejido conectivo. Además, la presencia de vitamina C como cofactor es, en términos fisiológicos, innegociable: sin ella, la hidroxilación necesaria para formar la triple hélice del colágeno se detiene, comprometiendo la integridad del nuevo tejido (Quintero et al., 2018). Esto no implica recurrir a suplementos de vitamina C —la idea es alcanzarla mediante la dieta— ni, mucho menos, considerar este micronutriente como algo más que una de las piezas del puzle.
Pero hasta la pauta nutricional más perfecta resulta estéril si no va acompañada del estímulo que activa la mecanotransducción. Como vimos en Tendinopatía, ejercicio físico y estiramientos. Un pequeño resumen de la evidencia actual (Valero, 2026), los tenocitos —las células responsables de “fabricar” el tendón— son mecanosensibles: requieren una señal física para activar la transcripción de genes vinculados al colágeno tipo I. Los protocolos de rehabilitación de 2025 subrayan que el ejercicio isométrico y el excéntrico controlado actúan como un “interruptor” biológico, ordenando a las células dónde y cómo depositar el material proteico (Scott et al., 2015). Sin ese estrés mecánico organizado, el organismo carece de un motivo fisiológico para invertir recursos en la remodelación de un tejido que, en la práctica, no está siendo exigido (Jensen, 2025).
Siguiendo con la práctica que más beneficios demuestra —el ejercicio físico, entendido siempre como una práctica adecuada, pues lo contrario sería contraproducente—, pasamos a transcribir un breve fragmento de El arte de cuidar de nuestro cuerpo (Valero, 2025), por la importancia de no mirar al músculo únicamente por su actividad contráctil y de comprender el papel de las mioquinas[7]; por ejemplo, la: «IL–6: o interleuquina 6, puede inducir efectos antiinflamatorios después de una sesión de EF; como consecuencia del entrenamiento se reduce la adiposidad abdominal y cardíaca, mediante un mecanismo que implica un aumento de la IL-6 inducido por el ejercicio y esto conduce a una disminución mayor de las citoquinas proinflamatorias. También retrasa la velocidad del vaciado gástrico, importante regulador de la glucosa postprandial, contribuyendo todavía más a reducir la inflamación crónica (puesto que la hiperglucemia provoca inflamación)».
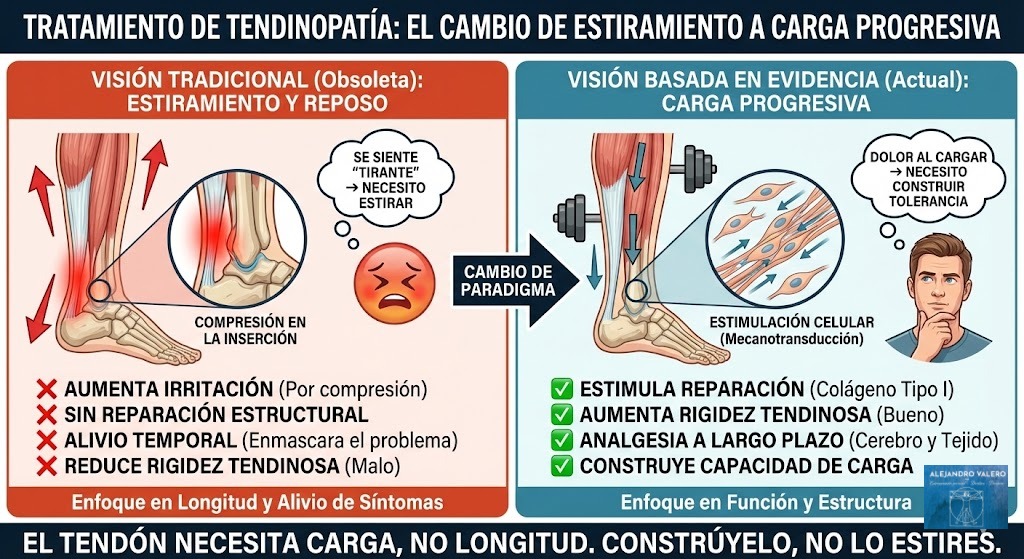
A la luz de lo mentado, la jerarquía de una recuperación exitosa en 2025 se aleja de la suplementación múltiple y se asienta sobre tres pilares científicos: carga mecánica progresiva —para señalizar la necesidad de reparación—, una ingesta nutricional adecuada y, esto es un añadido de cosecha propia —pero no incorrecto ni tampoco acientífico—, ausencia de malos hábitos o conductas perjudiciales para la lesión. Este enfoque integral no solo es más económico y posee una utilidad transferible a otros ámbitos, sino que es el único que respeta la compleja fisiología del tejido conectivo humano (Tipton, 2015). La recuperación real no se compra en un bote de cápsulas; se construye mediante la sinergia entre el estímulo físico y la suficiencia de macronutrientes (Valero, 2025).
Por otro lado, el uso de suplementos de colágeno para el tratamiento de enfermedades reumáticas sigue siendo un tema de debate en la literatura clínica actual, caracterizado por una evidencia que UpToDate califica como de baja calidad o inconsistente. Aunque algunos estudios sugieren que el colágeno tipo II no desnaturalizado (UC-II) podría modular la respuesta inmunitaria y reducir levemente el dolor en pacientes con artrosis de rodilla, no existe evidencia sólida que demuestre la regeneración del cartílago hialino en humanos (Devereaux, & Hunter, 2025). Por lo tanto, las guías clínicas internacionales mantienen una recomendación débil o incierta, enfatizando que estos suplementos no deben sustituir a los fármacos modificadores de la enfermedad ni a las intervenciones no farmacológicas de primera línea, como el ejercicio terapéutico.
A pesar de la popularidad comercial, las revisiones masivas más recientes (umbrella reviews) publicadas entre 2023 y 2024 concluyen que la evidencia para recomendar glucosamina, condroitina o colágeno sigue siendo insuficiente y clínicamente irrelevante cuando se excluyen los sesgos de financiación. Un metaanálisis en red de 2023 que comparó 23 suplementos diferentes encontró que, aunque algunos muestran significancia estadística marginal, ninguno alcanza de manera consistente la diferencia mínima clínicamente importante (MCID) para el dolor a largo plazo frente al placebo (Behrens et al., 2023).
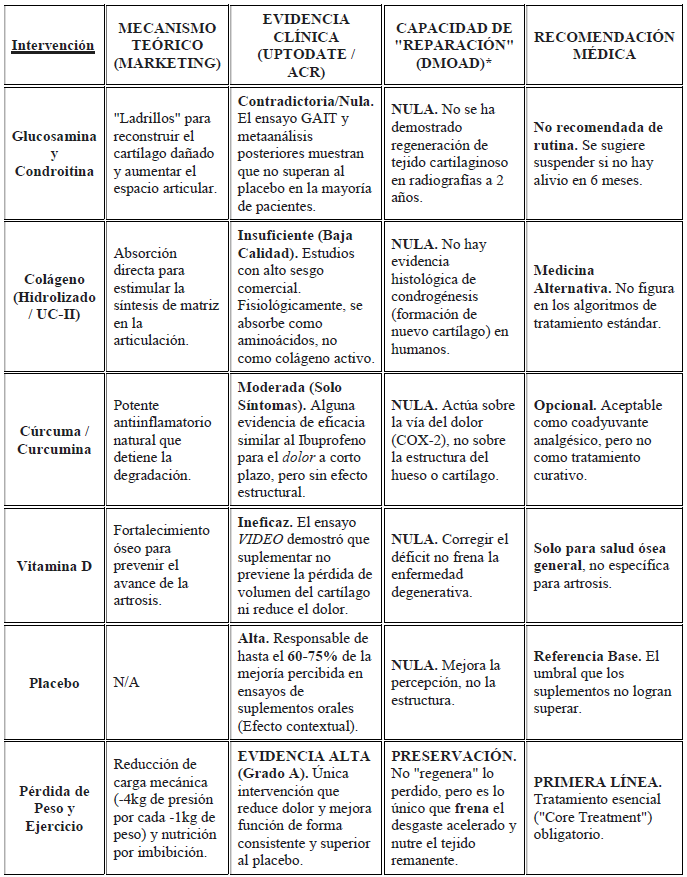
* DMOAD (Disease-Modifying Osteoarthritis Drug) es el término médico para un fármaco que modifica la enfermedad. A fecha de 2026, ningún suplemento ha logrado esta clasificación ante la FDA o la EMA.
De hecho, las guías clínicas globales actualizadas de la OARSI (Sociedad Internacional de Investigación en Osteoartritis) y el Colegio Americano de Reumatología mantienen en sus revisiones de 2024 una recomendación en contra del uso rutinario de estos suplementos, advirtiendo que los efectos positivos reportados en ensayos recientes suelen correlacionarse con defectos metodológicos y financiación de la industria, y no con una eficacia biológica real superior a la intervención placebo (Katz et al., 2024; Rannou, & Reginster, 2023).
En cuanto a otros productos populares, la evidencia científica actual, basada en ensayos clínicos independientes y revisiones sistemáticas de alta calidad metodológica, indica que los suplementos de glucosamina, condroitina y colágeno carecen de una eficacia clínica significativamente superior al placebo para el tratamiento de la osteoartritis. El ensayo fundamental financiado por los Institutos Nacionales de Salud (NIH), conocido como estudio GAIT[8], demostró que la combinación de glucosamina y condroitina no ofrece un alivio del dolor significativamente mayor que el placebo en la población general estudiada (Clegg et al., 2006). Del mismo modo, aunque ciertos estudios sobre el colágeno hidrolizado reportan beneficios estadísticos, metaanálisis recientes advierten que estos resultados provienen predominantemente de investigaciones financiadas por la industria con alto riesgo de sesgo, y que la magnitud del efecto no alcanza la MCID necesaria para que el paciente perciba una mejora real sobre el efecto placebo (Liu et al., 2018). En consecuencia, las guías de práctica clínica más rigurosas, como las del Colegio Americano de Reumatología, desaconsejan condicionalmente o rechazan el uso de estos nutracéuticos, priorizando intervenciones biomecánicas y de pérdida de peso[9] (Kolasinski et al., 2020).

También es conveniente señalar que el sulfato de glucosamina y la condroitina pueden producir efectos adversos gastrointestinales leves, como dispepsia, náuseas, dolor epigástrico o diarrea, especialmente en el caso de la glucosamina y a dosis habituales de 1500 mg/día (Towheed et al., 2005; Wandel et al., 2010). No existe evidencia sólida de que causen lesión gástrica estructural comparable a la de los AINE, pero sí pueden empeorar síntomas digestivos preexistentes en personas con gastritis funcional o intolerancia gastrointestinal (Rannou, & Reginster, 2023). En el caso de la glucosamina, además conviene advertir que puede potenciar la anticoagulación cuando se administra junto a cumarínicos —como la warfarina o el acenocumarol, más conocido como Sintrom—, con el consiguiente aumento del INR y del riesgo hemorrágico; además, esta interacción puede desestabilizar la pauta y dificultar el ajuste de la posología (NCCIH, 2023; Tan, & Lee, 2021).
Estos hallazgos sugieren que su uso deba valorarse con cautela, sabiendo que el beneficio clínico esperado es limitado e individualizando. Sobre todo en adultos mayores, es necesario contemplar la balanza riesgo-beneficio antes de tomar una decisión. Estos hallazgos sugieren que su uso deba valorarse con cautela, sabiendo que el beneficio clínico esperado es limitado e individualizando, sobre todo en adultos mayores, la balanza riesgo-beneficio antes de tomar una decisión.
Continuando la senda del cui prodest, estos suplementos solo demuestran regenerar eficazmente el bolsillo de quienes los comercializan. Es un asunto complejo y lleno de matices que he procurado esclarecer con el mayor rigor, sin dejar margen a la ambigüedad ni a los sesgos; si, pese a ello, al cerrar estas líneas aún les acompaña la duda, en la bibliografía encontrarán una prolongación natural de la lectura —no en vano he seleccionado multitud de trabajos de acceso abierto—. Como corolario de esta publicación y guinda para el pastel, voy a adjuntarles un pequeño extracto de El arte de cuidar la mente (Valero, 2025a): «Atendamos a lo más importante: el no abandonarse a ninguna terapia que no cuente con evidencia empírica y rechazar las que sí la tienen. Da igual si a otros les ha servido, no conocemos la casuística entera de esos otros ni el impacto que pueda tener en nosotros aquello que a otro le ha funcionado. Quizá tampoco poseamos el conocimiento médico y/o científico que requiera el entender algunos procesos, por lo que, aunque se produjera un beneficio aparente, el riesgo no será conocido hasta que sea padecido. A la hora de adquirir un producto, es necesario reclamar la evidencia disponible sobre el funcionamiento y resultados de dicho producto,» (Valero, 2025).
Alejandro.

Bibliografía:
Bischof, K., Moitzi, A. M., Stafilidis, S., & König, D. (2024). Impact of collagen peptide supplementation in combination with long-term physical training on strength, musculotendinous remodeling, functional recovery, and body composition in healthy adults: A systematic review with meta-analysis. Sports Medicine, 54, 2865–2888.
Behrens, M., Mauch, M., & Zacher, J. (2023). Efficacy of nutraceuticals in knee osteoarthritis: A systematic review and network meta-analysis of randomized controlled trials. Osteoarthritis and Cartilage, 31(4), 567–580.
Buhrmann, C., et al. (2017). Curcumin attenuates effects of IL-1β on tenocytes: A molecular target for tendon repair. International Journal of Molecular Sciences, 18(11), 2467.
Clegg, D. O.; … et al. (2006). Glucosamine, chondroitin sulfate, and the two in combination for painful knee osteoarthritis. The New England Journal of Medicine, 354(8), 795–808.
Close, G. L., et al. (2019). Nutrition for the Prevention and Treatment of Injuries in Track and Field Athletes. IJSNEM, 29(2).
Devereaux, P. J., & Hunter, D. J. (2025). Complementary and alternative therapies for osteoarthritis. En R. F. Connor (Ed.), UpToDate. Wolters Kluwer.
EFSA Panel on Dietetic Products, Nutrition and Allergies. (2009). Scientific Opinion on the substantiation of health claims related to glucosamine and maintenance of joints (ID 1537, 1538, 1539, 1540, 1541, 1542, 1543, 1544, 1545, 1546, 1547, 1548, 1549, 1550, 1551, 1552, 1553, 1554, 1555, 1556, 1557, 1558, 1559, 1560, 1561, 1562, 1563, 1564, 1565) pursuant to Article 13(1) of Regulation (EC) No 1924/2006. EFSA Journal, 7(9), 1264.
EFSA Panel on Dietetic Products, Nutrition and Allergies. (2009). Scientific Opinion on the substantiation of health claims related to chondroitin and chondroitin sulphate and maintenance of joints (ID 1504, 1505) pursuant to Article 13(1) of Regulation (EC) No 1924/2006. EFSA Journal, 7(9), 1262.
EFSA Panel on Dietetic Products, Nutrition and Allergies. (2011). Scientific Opinion on the substantiation of health claims related to collagen hydrolysate and maintenance of joints (ID 1630, 1876, 1877, 1878, 1879, 1914, 4310) pursuant to Article 13(1) of Regulation (EC) No 1924/2006. EFSA Journal, 9(7), 2291.
European Food Safety Authority. (2012). Scientific Opinion on the substantiation of health claims related to glucosamine and maintenance of normal cartilage (ID 4272) pursuant to Article 13(1) of Regulation (EC) No 1924/2006. EFSA Journal, 10(5), 2691.
Hijlkema, A.; …et al. (2022). Impact of nutrition on tendon health and tendinopathy: A systematic review. [Revisión citada en UpToDate].
Jensen, O. (2025). Redefining Sports Nutrition for Immune Health and Recovery. Journal of Nutrition and Food Sciences, 15(64), 1102-1115.
Katz, J. N., Arant, K. R., & Lo, G. H. (2024). A Review of Current Pharmacologic and Non-pharmacologic Therapies for Osteoarthritis. JAMA, 331(5), 425–436.
Kirmse, M., Hein, V., Schäfer, R., & Platen, P. (2024). Collagen peptide supplementation and musculoskeletal performance: A systematic review and meta-analysis. Deutsche Zeitschrift für Sportmedizin, 75, 179–188. https://doi.org/10.5960/dzsm.2024.605
Kolasinski, S. L.; … et al. (2020). 2019 American College of Rheumatology/Arthritis Foundation Guideline for the Management of Osteoarthritis of the Hand, Hip, and Knee. Arthritis & Rheumatology, 72(2), 220–233.
Liang, C.-W., Cheng, H.-Y., Lee, Y.-H., Liao, C.-D., & Huang, S.-W. (2024). Efficacy and safety of collagen derivatives for osteoarthritis: A trial sequential meta-analysis. Osteoarthritis and Cartilage, 32(5), 574–584.
Li, H., et al. (2025). Natural active compounds in tendon repair: Multi-target and multi-pathway mechanisms. Frontiers in Sports and Active Living, 7, 1081129.
Liu, X.; …et al. (2018). Dietary supplements for treating osteoarthritis: A systematic review and meta-analysis. [Revisión citada en UpToDate].
Mattioli, S. (2025). Proteins for protein synthesis: Quantity and timing. Progress in Nutrition, 27(1), 16716.
Miner-Williams, W. M., Stevens, B. R., & Moughan, P. J. (2014). Are intact peptides absorbed from the healthy gut in the adult human? Nutrition Research Reviews, 27(2), 308–329.
National Center for Complementary and Integrative Health. (2023, October). Glucosamine and chondroitin for osteoarthritis: What you need to know. https://www.nccih.nih.gov/health/glucosamine-and-chondroitin-for-osteoarthritis-what-you-need-to-know
Puce, M., et al. (2025). Prospective Short-Term Observational Study of Glucosamine Complex with Chondroprotectors Effect. Health, 17(4), 405-424.
Quintero, J. L., et al. (2018). Nutrición y lesiones deportivas. Revista Internacional de Medicina y Ciencias de la Actividad Física y el Deporte, 18(71).
Rannou, F., & Reginster, J. Y. (2023). The efficacy of SYSADOAs (Symptomatic Slow-Acting Drugs in Osteoarthritis): A critical update. Seminars in Arthritis and Rheumatism, 58, 152-160.
Raymond, J. L., & Morrow, K. (2023). Krause and Mahan’s Food & the Nutrition Care Process (16th ed.). Elsevier.
Simental-Mendía, M., Ortega-Mata, D., Acosta-Olivo, C. A., Simental-Mendía, L. E., Peña-Martínez, V. M., & Vilchez-Cavazos, F. (2025). Effect of collagen supplementation on knee osteoarthritis: An updated systematic review and meta-analysis of randomised controlled trials. Clinical and Experimental Rheumatology, 43(1), 126–134.
Scott, A., et al. (2015). Tendon humoral and mechanotransduction. Journal of Musculoskeletal and Neuronal Interactions, 15(2), 149-160.
Tan, C. S. S., & Lee, S. W. H. (2021). Warfarin and food, herbal or dietary supplement interactions: A systematic review. British Journal of Clinical Pharmacology, 87(2), 352–374.
Tipton, K. D. (2015). Nutritional Support for Exercise-Induced Injuries. Sports Medicine, 45(Suppl 1), 93-104.
Towheed, T. E., Maxwell, L., Anastassiades, T. P., Shea, B., Houpt, J., Welch, V., & Wells, G. (2005). Glucosamine therapy for treating osteoarthritis. Cochrane Database of Systematic Reviews, (2), CD002946.
Puce, M., et al. (2025). Prospective Short-Term Observational Study of Glucosamine Complex with Chondroprotectors Effect. Health, 17(4).
Quintero, J. L., et al. (2018). Nutrición y lesiones deportivas. Revista Int. de Med. y C. de la Actividad Física y el Deporte, 18(71).
Scott, A., et al. (2015). Tendon humoral and mechanotransduction. Journal of Musculoskeletal and Neuronal Interactions, 15(2).
Tipton, K. D. (2015). Nutritional Support for Exercise-Induced Injuries. Sports Medicine, 45(Suppl 1).
Valero, A. (2025a). El arte de cuidar de nuestro cuerpo. Ediciones Agoeiro.
Valero, A (2025b). El arte de cuidar la mente. McGraw-Hill – AULAMAGNA:
Valero, A. (2026). Tendinopatía, ejercicio físico y estiramientos. Un pequeño resumen de la evidencia actual. Alejandro Valero García. https://alejandrovalerogarcia.com/tendinitis-y-estiramientos-un-resumen-de-la-evidencia-actual/
Wandel, S., et al. (2010). Effects of glucosamine, chondroitin, or placebo in patients with osteoarthritis: Network meta-analysis. BMJ, 341, c4675.
Yuenyongviwat, V., Anusitviwat, C., Tuntarattanapong, P., Hongnaparak, T., & Iamthanaporn, K. (2025). Efficacy of combined undenatured type II collagen and hydrolysed collagen supplementation in knee osteoarthritis: A randomised controlled trial. Scientific Reports, 15, Article 32313.
Cómo citar esta publicación:
Valero, A. (2026). El colágeno ingerido, ¿sin efecto prometido? Alejandro Valero García. https://alejandrovalerogarcia.com/el-colageno-ingerido-sin-efecto-prometido/

[1] Es conveniente resaltar, como podremos apreciar líneas más abajo o consultando la bibliografía, que una gran parte de las investigaciones que muestran resultados favorables es financiada por las mismas empresas que comercializan los suplementos de colágeno, lo que genera dudas sobre la imparcialidad de los hallazgos.
[2] PepT1 es un transportador de la pared del intestino delgado que introduce en las células intestinales pequeños péptidos (sobre todo di- y tripéptidos) para facilitar su absorción.
[3] Aprovechemos para aportar que: «La cantidad de proteína no debe ser contemplada únicamente en gramos, sino en la calidad de sus aminoácidos, priorizando un contenido favorable de aminoácidos esenciales para que la síntesis proteica sustente las adaptaciones que procuramos con el entrenamiento» (Valero, 2025).
[4] Un estudio pivotal es un ensayo clínico crucial diseñado para demostrar de forma concluyente la eficacia y seguridad de un nuevo tratamiento (fármaco o intervención). Mediante este estudio se proporciona la evidencia necesaria para que las autoridades reguladoras aprueben su comercialización y uso generalizado en la práctica clínica.
[5] La vía NF-κB es un “interruptor” molecular dentro de la célula que, cuando se activa, enciende genes que coordinan la respuesta inflamatoria y de defensa (por ejemplo, ante infecciones o daño tisular).
[6] Cantidad que puede verse incrementada en función de las demandas por actividad física.
[7] Las mioquinas son proteínas mensajeras que el músculo libera al contraerse para comunicarse químicamente con otros órganos y regular funciones vitales como el metabolismo, factores inmunológicos y neurológicos, o la inflamación.
[8] El ensayo clínico GAIT sobre 1583 pacientes con osteoartritis sintomática de rodilla (Clegg et al., 2006), financiado independientemente por los NIH, permanece como el estándar de referencia indiscutible al demostrar que la combinación de glucosamina y condroitina no supera estadísticamente al placebo en el alivio del dolor por artrosis. Su validez científica es totalmente equiparable y vigente respecto a la literatura de 2025, dado que las revisiones sistemáticas actuales confirman que, cuando se aplica el mismo rigor metodológico y se eliminan los conflictos de interés comerciales, los resultados de ineficacia se mantienen inalterados dos décadas después.
[9] Señalamos que las guías clínicas globales actualizadas de la OARSI (Sociedad Internacional de Investigación en Osteoartritis) y el Colegio Americano de Reumatología mantienen en sus revisiones de 2024 una recomendación no favorable al uso rutinario de estos suplementos, advirtiendo que los efectos positivos reportados en ensayos recientes suelen correlacionarse con defectos metodológicos y financiación de la industria, y no con una eficacia biológica real superior a la intervención placebo (Katz et al., 2024; Rannou, & Reginster, 2023).


