Introducción:
El ayuno intermitente (a partir de ahora: AI) se ha convertido en un asunto polémico que ha capturado buena parte del discurso de algunos profesionales y, especialmente, de pseudoprofesionales inclinados a lecturas maniqueas que sacrifican el conjunto en favor del fragmento[1]. También ha cautivado a una gran parte de la población ávida de recetas fáciles seducida por la inmediatez posmoderna y la oratoria —y mercadotecnia, en términos generales— de quienes priorizan el cómo vender un producto por encima del producto en sí. Antes de entrar en materia, adjuntaremos un pequeño fragmento de El arte de cuidar la mente para advertirles que «no se trata de que a alguien le funcione (insisto, en el mejor de los casos), se trata de demostrar que a los demás también les puede funcionar, aportando hechos que puedan ser replicables y cuenten con la suficiente evidencia» (Valero, 2025b).
El debate importa porque exige separar la expectativa divulgativa de la evidencia clínica; de ahí que el trabajo que sigue se justifique en un análisis crítico de su eficacia y seguridad en humanos, confrontando su popularidad con evidencia de alta jerarquía y con guías de práctica recientes (2024-2026). Esta investigación evalúa si la restricción temporal constituye realmente una herramienta superior o si, por el contrario, la prudencia dicta un retorno a la pauta dietética distribuida como marco más sólido y sostenible cuando hablamos de salud.
Mediante esta publicación se pretende realizar una síntesis que esclarezca los aspectos más importantes —centrándonos en la eficacia y la seguridad de esta práctica—, así como servir de guía o faro para quienes deseen ampliar información. Para ello, se ha implementado una metodología de investigación basada en una revisión bibliográfica de alta jerarquía; el análisis se ha circunscrito prioritariamente a ensayos clínicos aleatorizados (ECA), revisiones paraguas (umbrella reviews)[2] y guías de práctica clínica vigentes, aplicando criterios de exclusión estrictos para descartar modelos preclínicos[3] y estudios observacionales transversales propensos al sesgo de confusión, garantizando así que las conclusiones clínicas se fundamenten exclusivamente en la evidencia de mayor robustez causal disponible en la literatura contemporánea y permitan destilar una conclusión libre de ruido mediático[4]. Para este análisis, he aplicado un filtro de «rigor extremo»; he descartado estudios observacionales —que solo muestran correlación y suelen tener sesgos— y modelos animales —cuya fisiología metabólica difiere de la humana—, lo que recorta mucho el corpus disponible.

Desgranando el ayuno:
En el espíritu de nuestro tiempo, dominado por la incesante búsqueda de la optimización biológica —hasta el punto de que Steven Bratman acuñó, a finales del siglo pasado, el término ortorexia para designar la obsesión por la alimentación saludable[5]—, el ayuno intermitente emergió como una promesa de eficiencia metabólica con numerosos beneficios que cautivó parte del discurso público. Sin embargo, el rigor científico de la última etapa (2024-2026) ha comenzado a desdibujar ese espejismo. La justificación de este análisis reside en la necesidad urgente de confrontar dicha popularidad con la evidencia clínica de alta jerarquía, la cual, lejos de validar una superioridad intrínseca frente a la restricción calórica convencional, alerta sobre riesgos a menudo silenciados por la tendencia. Así, este trabajo pretende discernir si el AI es realmente una herramienta terapéutica superior o si, por el contrario, la prudencia y los datos dictan un retorno a la pauta dietética distribuida y estructurada como único garante sostenible de la salud a largo plazo.
Cuando hablamos de «ayuno intermitente» no lo hacemos de una intervención única, sino de una familia de protocolos: restricción temporal de la ingesta (o TRE; verbigracia, comer en una ventana de 8 h y ayunar en otra de 16), ayuno en días alternos (ADF o versiones modificadas) y restricción energética intermitente (por ejemplo, 5:2 o comer “normal” durante cinco días y realizar una restricción energética severa durante dos). Esta heterogeneidad importa porque la pregunta clínica se desdobla en dos: si el beneficio se explica, sobre todo, por un déficit calórico —menos energía total y mayor facilidad de adherencia— o si existe un efecto adicional del patrón horario o de los días de ayuno, independiente de las calorías y de la pérdida de peso (Sun et al., 2024). Con la evidencia actualmente disponible, predomina la primera hipótesis; la segunda solo puede estimarse con validez en ensayos que controlen de forma estricta la ingesta energética y la variación del peso corporal
Cuando se sintetiza la evidencia causal procedente de ensayos aleatorizados en revisiones de alto nivel, el mensaje central es consistente: el ayuno intermitente puede mejorar el peso y algunos marcadores cardiometabólicos frente a una ingesta ad libitum[6], pero no muestra una superioridad robusta frente a la restricción energética continua cuando el déficit calórico y el apoyo conductual son comparables (Allaf et al., 2021; Sun et al., 2024). Además, la certeza de la evidencia para los desenlaces cardiometabólicos suele ser baja o muy baja, ya que muchos ensayos son de corta duración, con tamaños muestrales modestos y con una adherencia que se deteriora con el tiempo (Allaf et al., 2021). Por tanto, el núcleo de la evidencia respalda la afirmación «puede funcionar», pero no «es un enfoque intrínsecamente superior».
Una de las bondades atribuidas al ayuno que más se repite —aquí abordaremos evidencia, no beneficios supuestos sin respaldo demostrable— es la autofagia. Sin embargo, la autofagia no es exclusiva del ayuno: se trata de un proceso basal de recambio celular que también puede modularse mediante el ejercicio y la restricción energética. En humanos, no obstante, la evidencia directa es más limitada que en modelos animales, y su interpretación exige cautela, porque muchos estudios emplean marcadores indirectos (por ejemplo, LC3/p62, utilizado para medir este proceso de reciclaje celular) que no siempre reflejan con fidelidad el flujo autofágico real. Por ello, no puede afirmarse que el ayuno sea necesario para activar los mecanismos de autofagia ni que cualquier variación en biomarcadores implique, por sí misma, un beneficio clínico automático (Mizushima, & Levine, 2020; Bagherniya et al., 2018).
Introduzcamos un espacio dedicado a la salud cardiovascular. La seguridad cardiovascular del ayuno intermitente (también referido como alimentación con restricción de tiempo o TRF, por sus siglas en inglés) ha sido cuestionada tanto por ensayos clínicos recientes como por metaanálisis fisiológicos que priorizan la calidad del patrón dietético sobre la manipulación de la ventana de ingesta. En un análisis de cohorte presentado ante la American Heart Association, (Zhong et al., 2024) reportaron una asociación significativa entre una ventana de alimentación restringida a menos de 8 horas y un incremento del 91% en el riesgo de mortalidad cardiovascular.
Este hallazgo se alinea con la evidencia previa sobre la omisión del desayuno —una práctica común en el TRF 16:8, que explicaremos más adelante—, la cual se asocia de forma independiente con un aumento del 87 % en la mortalidad cardiovascular según metaanálisis publicados en el Journal of the American College of Cardiology (Rong et al., 2019). Esta señal de alarma epidemiológica es consistente con la ausencia de beneficio terapéutico adicional observada en el ensayo clínico de referencia de Liu y colaboradores (2022), donde la adición de ayuno a la restricción calórica no mejoró los marcadores cardiometabólicos. Tales datos respaldan las directrices de la American Society for Preventive Cardiology (2022), que priorizan la calidad del patrón dietético sobre la restricción horaria[7], sugiriendo que la concentración de la ingesta podría inducir una respuesta maladaptativa de estrés matutino y cronodisrupción metabólica.
No obstante, calificar el ayuno intermitente como intrínsecamente ‘perjudicial’ sería una imprecisión terminológica dada la ausencia de toxicidad aguda en ensayos clínicos controlados, además de que, como señalamos, existen diferentes tipos de ayuno con distintos impactos. Es necesario aportar también que los datos arrojados están basados en una práctica constante y no eventual. Sin embargo, definirlo como una estrategia ‘segura a largo plazo’ sería igualmente imprudente a la luz de la evidencia epidemiológica reciente. La postura más rigurosa es considerarlo una intervención de seguridad incierta y sin superioridad terapéutica, cuyo mayor perjuicio potencial radica en el ‘coste de oportunidad’: la adopción de la restricción horaria a menudo desplaza patrones dietéticos cualitativamente superiores y somete al organismo a una cronodisrupción innecesaria cuyos efectos deletéreos sobre la mortalidad cardiovascular parecen emerger tras años de exposición continuada. Podríamos concluir con que la prevención cardiovascular depende del estilo de vida: la adopción de patrones dietéticos de alta calidad sin olvidarse nunca del mejor coadyuvante: ejercicio físico y sus innumerables ventajas como en la prevención e incluso en la patología cardiovascular —como puede leerse detalladamente en El arte de cuidar de nuestro cuerpo—, y no de la restricción horaria per se.
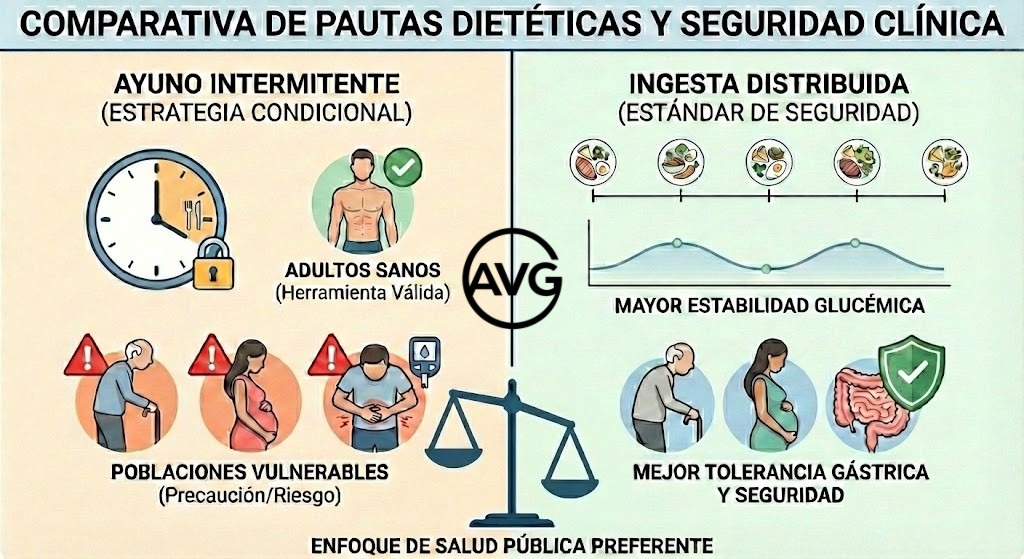
Abordemos ahora el que quizá sea el bloque más socialmente popular: ayuno intermitente y adelgazamiento. Si hablamos de pérdida de peso, la comparación más informativa es «ayuno frente a restricción diaria» cuando la intervención conductual es equivalente en ambos grupos. Un ensayo aleatorizado que comparó el ayuno en días alternos (alternate-day fasting, o ADF) de “cero calorías” con restricción diaria, en adultos con obesidad, observó descensos ponderales en ambos grupos, sin una ventaja sostenida del ADF sobre la restricción diaria; la lectura práctica es que el resultado depende de mantener el déficit energético y la adherencia, no del formato (Catenacci et al., 2016). Este tipo de ensayo también explica por qué algunos documentos clínicos concluyen que «no es más efectivo»: de nuevo, el comparador relevante no es la dieta habitual, sino una intervención estándar bien aplicada en ambos grupos.
En adultos con obesidad, la evidencia humana reciente indica que el ayuno intermitente puede reducir peso y grasa corporal, pero sigue sin demostrar una superioridad consistente frente a la restricción calórica continua cuando el déficit energético y el soporte conductual son comparables (Semnani-Azad et al., 2025; Siles-Guerrero et al., 2024). En términos de composición corporal, los efectos sobre masa libre de grasa suelen ser similares entre estrategias, con diferencias pequeñas y heterogéneas entre protocolos, duraciones y poblaciones (Sun et al., 2024).
Cuando el análisis se dirige a personas sin obesidad o a poblaciones sanas de mediana y avanzada edad, el objetivo suele formularse así: obtener beneficio metabólico sin pérdida de masa muscular[8] ni deterioro de la calidad nutricional. Un ensayo piloto en adultos sanos no obesos indicó que un TRE[9] de corta duración fue factible y bien tolerado, sin señales de perjuicio sobre masa magra, densidad ósea o ingesta de nutrientes; los cambios cardiovasculares fueron limitados en ese contexto, aunque se observaron mejoras modestas en tolerancia a la glucosa y en la capacidad funcional (Martens et al., 2020). La lectura clínica es prudente: en población sana, el TRE no opera como un “acelerador” cardiometabólico fiable a corto plazo; su utilidad, una vez más, parece residir más en el plano conductual —como estructura de adherencia— o, en todo caso, en perfiles metabólicos concretos.
La relevancia del “cuándo” —y no solo del “cuánto”— también aparece en un ensayo aleatorizado en voluntarios sanos sin obesidad que comparó TRE temprano, TRE de media jornada y TRE de control: el TRE temprano mostró ventajas frente al TRE de media jornada en sensibilidad a la insulina y en algunos parámetros metabólicos, con buena tolerabilidad y sin eventos adversos graves reportados (Xie et al., 2022). En conjunto con Sutton, estos datos sugieren que, si existe un efecto específico propio del horario, resulta más plausible cuando la ventana de ingesta se desplaza hacia la primera parte del día.
La hipótesis de un beneficio “independiente del adelgazamiento” se sostiene solo si el ensayo controla la ingesta y evita pérdida de peso. Un estudio controlado de alimentación supervisada en hombres con prediabetes probó una forma de TRE temprano (comer en una ventana corta y terminar temprano) y observó mejoras en sensibilidad a la insulina y presión arterial sin pérdida de peso, lo que apoya un mecanismo ligado a ritmos circadianos y a la sincronía entre ingesta y metabolismo (Sutton et al., 2018). Este resultado es relevante, pero no debe sobregeneralizarse: se trata de un ensayo pequeño, con duración limitada y población muy concreta.
Para concluir esta parte, señalamos que en obesidad no puede sostenerse que el ayuno intermitente sea consistentemente superior a otras estrategias dietéticas bien implementadas y, en pacientes con comorbilidades frecuentes —por ejemplo, diabetes tipo 2 tratada con insulina o sulfonilureas[10]—, puede aumentar el riesgo de hipoglucemia si no existe ajuste terapéutico ni seguimiento estrecho. Por ello, en la práctica clínica suele ser más prudente priorizar intervenciones con eficacia comparable y mejor control de seguridad —restricción calórica continua, patrones dietéticos estructurados y actividad física—, reservando el ayuno, si es que se quiere adoptar esta estrategia a la luz de la evidencia, para casos seleccionados y supervisados (Allaf et al., 2021; American Diabetes Association Professional Practice Committee, 2024; Semnani-Azad et al., 2025).
Al abordar la relación entre el ayuno intermitente y la diabetes, la viabilidad del ayuno como terapia metabólica estándar ha sido revisada por guías clínicas recientes. Los Standards of Care in Diabetes—2024 de la American Diabetes Association (ADA) priorizan de forma explícita la seguridad glucémica y la sostenibilidad conductual por encima de la novedad terapéutica. En su actualización anual, el comité subraya la necesidad de patrones alimentarios que favorezcan una euglucemia —o normoglucemia, si se prefiere— sostenida y reduzcan el riesgo de hipoglucemia, especialmente en pacientes tratados con insulina o secretagogos[11] (ADA Professional Practice Committee, 2024). Aunque la guía contempla el ayuno intermitente como opción viable para la pérdida de peso en fenotipos concretos, no lo sitúa por encima de la pauta convencional ni le atribuye superioridad metabólica. De hecho, la recomendación explícita de monitorización intensiva en protocolos de ayuno refuerza, en términos clínicos, que la pauta distribuida y fraccionada continúa siendo el enfoque más seguro, fisiológicamente estable y mejor respaldado para el manejo poblacional de la disglucemia.
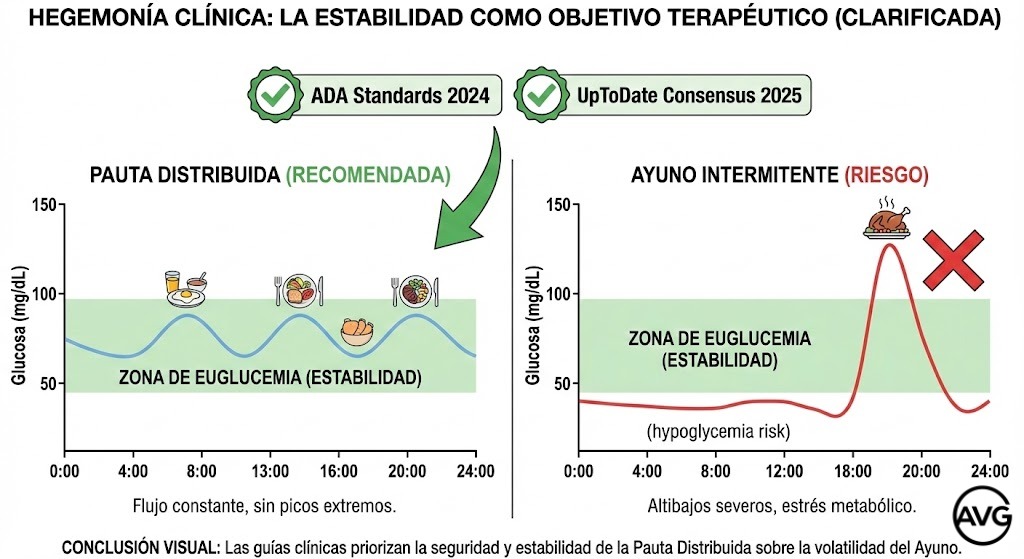
El veredicto conjunto de la investigación epidemiológica reciente (Zhong et al., 2024), las revisiones paraguas de alta jerarquía (Chen et al., 2024; Sun et al., 2024) y las guías clínicas vigentes es nítido: el ayuno intermitente no es ninguna panacea metabólica. Tanto la actualización clínica de UpToDate (Perreault, 2025) como los estándares de la ADA (2024) lo reubican como una herramienta coadyuvante, sin ventajas metabólicas independientes frente a la restricción calórica continua y con interrogantes abiertos sobre su seguridad cardiovascular a largo plazo. En consecuencia, la pauta dietética distribuida reafirma su hegemonía clínica como el «Gold Standard», ofreciendo el equilibrio óptimo entre eficacia ponderal, seguridad cardiovascular y adherencia a largo plazo, sin someter al paciente a los riesgos potenciales de la cronodisrupción y el estrés adaptativo.
Pasemos a otro argumento vinculado a los beneficios del ayuno: su impacto sobre la saciedad y la consiguiente regulación del apetito. Frente a la hipótesis de una adaptación metabólica capaz de atenuar de forma estable la percepción de hambre, la evidencia actual cuestiona la superioridad del ayuno intermitente sobre la restricción calórica continua (CER) en la modulación de la saciedad a largo plazo. Ensayos clínicos aleatorizados señalan que la prolongación del periodo de ayuno puede alterar el ritmo circadiano de hormonas orexigénicas[12]; en concreto, se ha descrito elevación o mantenimiento de la grelina acilada[13], junto con una disminución de péptidos de saciedad posprandial (GLP-1 y PYY) durante la ventana de restricción (Templeman et al., 2021). Aunque algunos sujetos refieren una atenuación subjetiva del hambre matutina tras la habituación, los análisis objetivos indican que esta “deuda de saciedad” fisiológica puede favorecer una ingesta compensatoria ad libitum en horas vespertinas, lo que dificulta la adherencia conductual en comparación con pautas de distribución fraccionada que sostienen una señalización anorexígena[14] más estable (Clayton, & James, 2016; Varady et al., 2022).
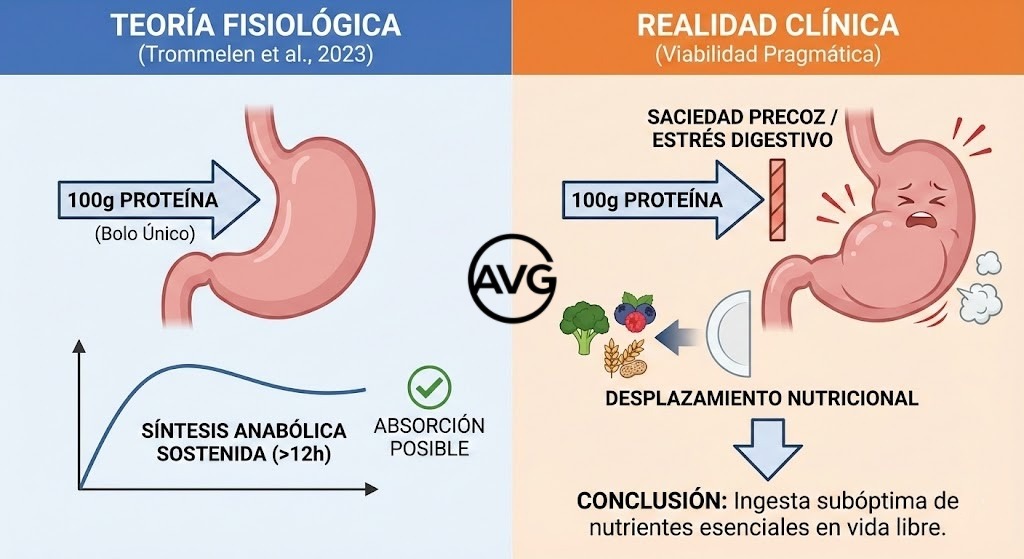
Continuemos abordando otra polémica: ¿los regímenes de ayuno perjudican la ganancia y el mantenimiento de la masa muscular? La concepción clásica sobre las limitaciones anabólicas del ayuno intermitente ha sido reevaluada de forma sustancial a la luz de la evidencia fisiológica reciente. Aunque históricamente se postuló un “techo” de utilización proteica por ingesta, investigaciones de referencia han mostrado que el consumo de bolos elevados de proteína (100 g) puede sostener una respuesta anabólica prolongada durante más de 12 horas, lo que cuestiona la premisa de que una menor frecuencia de ingestas comprometa mecánicamente la síntesis muscular (Trommelen et al., 2023). No obstante, la viabilidad fisiológica no se traduce automáticamente en superioridad clínica: revisiones sistemáticas y metaanálisis publicados en 2025 indican que, en condiciones de vida libre, la pérdida de peso inducida por ayuno intermitente se asocia a una reducción significativa de la masa libre de grasa (aprox. 0,81 kg), estadísticamente equiparable a la observada con restricción calórica continua, lo que desmiente la existencia de un efecto “protector” intrínseco del ayuno sobre el tejido magro (Hshieh et al., 2025).
En el plano aplicado, la preservación de la masa muscular bajo protocolos de restricción temporal parece depender, sobre todo, de la calidad de la ingesta y del estímulo mecánico, más que de la ventana horaria en sí misma. La evidencia actual indica que, en ausencia de entrenamiento de fuerza concurrente, el ayuno favorece la pérdida de masa muscular, comportándose como cualquier otro escenario de déficit energético (Sun et al., 2024; Wang et al., 2025). Por consiguiente, aunque la fisiología permita una absorción eficiente en ventanas cortas, la pauta dietética distribuida conserva su vigencia como estrategia más segura para asegurar la adherencia a los requerimientos proteicos totales, especialmente en población de mayor edad, donde el riesgo de sarcopenia deja escaso margen para errores nutricionales asociados con frecuencia a ventanas de alimentación restringida.
Por lo tanto, si bien la fisiología más reciente ha mostrado que el ser humano puede absorber grandes bolos de proteína (100 g) y sostener el anabolismo durante más de 12 horas (Trommelen et al., 2023), la traslación de ese hallazgo a la práctica clínica plantea límites claros por la carga gastrointestinal y por la barrera de adherencia que impone. Concentrar la totalidad de los requerimientos proteicos diarios en una ventana restringida puede generar saciedad precoz y malestar posprandial que, en condiciones reales, favorecen una ingesta subóptima de nutrientes esenciales. De hecho, las revisiones paraguas más recientes confirman que esta dificultad logística impide que el ayuno intermitente supere a la dieta distribuida: la pérdida de peso mediante restricción horaria no preserva mejor la masa magra y, con frecuencia, se asocia a peor calidad dietética por la compresión de las comidas (Chen et al., 2024; Sun et al., 2024).
En consecuencia, la superioridad de la dieta distribuida no se explica por una supuesta limitación molecular de absorción, sino por su viabilidad pragmática. El fraccionamiento de la ingesta reduce el estrés digestivo y facilita el cumplimiento de los requerimientos proteicos totales sin desplazar otros alimentos de alto valor nutricional —fibra y vegetales principalmente—, sin olvidarnos de los preciados micronutrientes. La evidencia de 2024 ratifica que, cuando se iguala el déficit calórico, el ayuno no aporta beneficios metabólicos adicionales y añade una complejidad conductual que puede comprometer la sostenibilidad a largo plazo y la integridad muscular frente a una pauta estructurada y regular (Sun et al., 2024; Trommelen et al., 2023).
La concentración de la ingesta diaria en ventanas temporales reducidas impone un desafío fisiológico dual que puede comprometer la homeostasis renal y gastrointestinal. Aunque la hiperfiltración glomerular asociada a cargas proteicas elevadas se considera, en sujetos sanos, un mecanismo adaptativo generalmente seguro (Antonio et al., 2015; Devries et al., 2018), esta estrategia puede entrañar riesgos en poblaciones vulnerables, al aumentar la presión intraglomerular y favorecer la litogénesis[15] en pacientes con función renal comprometida (Ko et al., 2020). De forma simultánea, la saturación de la capacidad absortiva intestinal puede promover el fenómeno de “derrame proteico” (protein spillover), desviando sustratos nitrogenados al colon, donde sufren fermentación proteolítica con potencial citotóxico (Diether, & Willing, 2019; Yao et al., 2016). Si a ello se suma el estrés mecánico asociado al reflujo por distensión gástrica (Iwakiri et al., 2016), la pauta dietética distribuida se perfila como un enfoque más seguro para preservar la integridad orgánica y minimizar la carga sistémica.
Aunque existan estudios indicando que el cuerpo humano tiene capacidad para absorber grandes bolos proteicos, la realidad clínica muestra barreras prácticas. Por ejemplo, el estudio de Cardoso y colaboradores (2022) evidencia que en poblaciones de riesgo, como mujeres posmenopáusicas, el ayuno se asocia a una mayor pérdida de masa libre de grasa en comparación con la dieta distribuida, debido a la dificultad de alcanzar la ingesta proteica óptima en ventanas reducidas. Una vez más, conviene apelar a la tranquilidad y a la prudencia a la hora de interpretar conclusiones, ya que estos procesos no se producen de un día para otro, sino tras el mantenimiento prolongado de una pauta perjudicial. Además, su aparición y magnitud dependen tanto de la duración de esa conducta como de su impacto en cada persona, en función de la casuística individual.
Por tanto, no puede afirmarse que el ayuno preserve mejor la masa muscular que otras estrategias, ni que la deteriore de forma inevitable, pero sí que no es la mejor estrategia para la mejora musculoesquelética. El resultado depende, sobre todo, del contexto de intervención —magnitud del déficit energético, calidad de la dieta, ingesta proteica y entrenamiento adecuado—; por ello, la elección clínica debe priorizar la estrategia que el paciente pueda mantener con seguridad y adherencia a medio y largo plazo (Semnani-Azad et al., 2025; Siles-Guerrero et al., 2024). Como matiz metodológico, conviene recordar que muchos ensayos evalúan masa libre de grasa y no siempre miden de forma directa la masa muscular esquelética.
Si, llegado a este punto, usted tiene decidido incorporar el AI a su estilo de vida, ya sea ocasional o temporalmente, intentaremos esclarecer qué práctica puede ser la más adecuada. Desde la perspectiva de la crononutrición, la localización temporal de la ventana de ingesta es un determinante crítico de la eficacia metabólica, y existe un consenso sólido sobre la mayor idoneidad fisiológica de la alimentación con restricción temporal temprana (eTRF), en la que la ingesta se concentra en las primeras horas del día y finaliza a media tarde. Esta modalidad se alinea con el ritmo circadiano del cortisol y con la sensibilidad a la insulina, que alcanza su máximo por la mañana y desciende progresivamente hacia la noche, lo que favorece el control glucémico y puede reducir la inflamación sistémica (Xie et al., 2022). Por el contrario, los protocolos tardíos que concentran la carga calórica en la cena inducen “desalineación circadiana”, deterioran la tolerancia a la glucosa y favorecen la lipogénesis, con la consiguiente atenuación de los beneficios teóricos del ayuno y un posible aumento del riesgo cardiometabólico (Che et al., 2024).
Conclusiones:
El AI puede ser beneficioso, pero su efecto es condicional y, en la práctica clínica real, su mecanismo principal suele ser facilitar un déficit energético sostenido y una estructura de comidas más adherente para algunas personas; no existe evidencia sólida de superioridad frente a la restricción continua cuando ambas se aplican correctamente (Allaf et al., 2021; Sun et al., 2024). Puede tener interés adicional en protocolos de TRE temprano en perfiles con alteración glucémica, por una posible ventaja circadiana independiente del peso; no obstante, la evidencia sigue siendo de escala limitada y sin desenlaces duros (Sutton et al., 2018; Xie et al., 2022). El “cómo” más defendible consiste en elegir el protocolo según adherencia, contexto social y tolerancia; si se busca un posible plus metabólico, conviene priorizar ventanas tempranas y, en todos los casos, vigilar la calidad dietética, asegurar suficientes nutrientes y evitar esta estrategia en perfiles de riesgo (como puedan serlo antecedentes de trastorno de la conducta alimentaria, embarazo o fragilidad), porque la evidencia de seguridad y del balance riesgo-beneficio a largo plazo continúa incompleta (Allaf et al., 2021; Martens et al., 2020).
En última instancia, el veredicto de la literatura científica contemporánea es claro: el AI pierde su condición de panacea y queda situado, en términos clínicos, como una estrategia sin superioridad metabólica consistente, además de acompañada por señales de posible riesgo en determinados contextos. Ante este escenario, la pauta dietética distribuida mantiene su primacía no por inercia ni por conservadurismo, sino por su mayor robustez clínica y su perfil de seguridad, al ofrecer un marco más sólido para compatibilizar el control del peso con la preservación fisiológica a largo plazo.
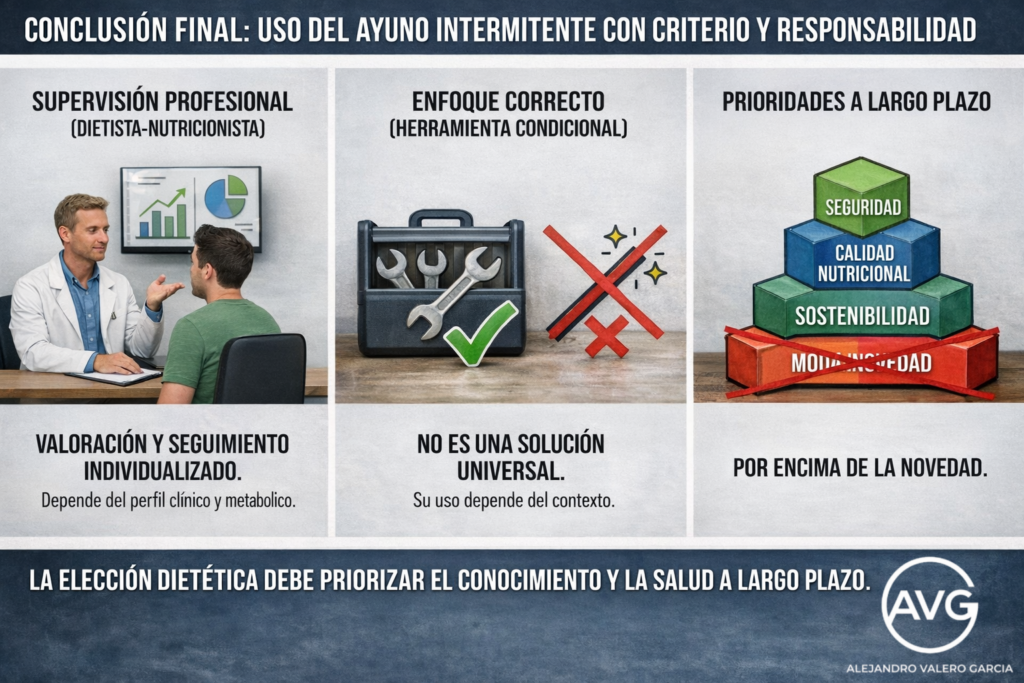
Aunque pueda constituir una herramienta válida en adultos sanos[16] con buena flexibilidad metabólica y sin patología digestiva relevante, el AI no puede considerarse la pauta superior en términos generales. En cambio, la distribución de la ingesta en tomas fraccionadas mantiene una ventaja clínica clara en poblaciones con enfermedad gastrointestinal, diabetes lábil, embarazo o edad avanzada, al ofrecer mejor tolerancia gástrica, mayor estabilidad glucémica y menor riesgo de saciedad precoz con ingesta insuficiente. Por ello, desde una perspectiva de salud pública y de manejo clínico integral, la pauta dietética fraccionada continúa siendo el estándar de seguridad, mientras que el ayuno debe reservarse como estrategia condicional para perfiles bien seleccionados.
Este texto no se escribe para rechazar el AI, sino para ofrecer información suficiente que permita tomar decisiones con criterio y responsabilidad, evitando actuar desde la nesciencia y caer en la máxima de que quien considera poco, rápido decide. En caso de hacer uso del ayuno, tal práctica exige valoración y seguimiento por parte de un dietista-nutricionista con experiencia en esta intervención, ya que la respuesta depende en gran medida del perfil clínico, metabólico y conductual de cada paciente. En práctica clínica, por tanto, el AI debe entenderse como una herramienta condicional, no como una solución universal. De ahí que toda elección dietética deba individualizarse y priorizar, por encima de la novedad y/o la moda, el conocimiento, la seguridad, la sostenibilidad y la calidad nutricional a largo plazo.
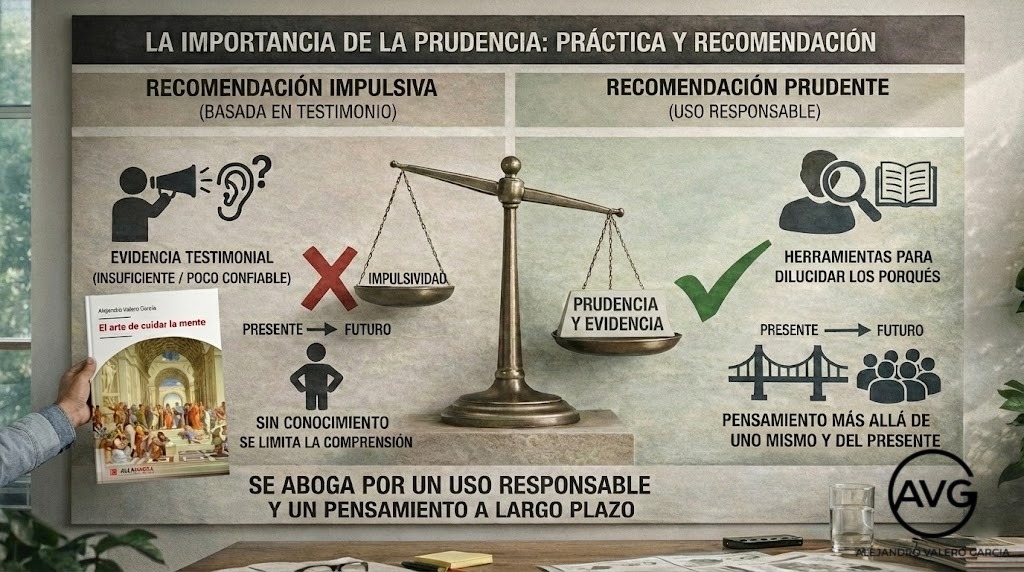
Terminamos la publicación con otro fragmento de El arte de cuidar la mente para recordarle que «la prudencia no solo es importante a la hora de practicar, sino también a la de recomendar. La evidencia testimonial no solo es insuficiente, sino que supone una fuente poco o nada confiable. Una vez que se poseen las herramientas para dilucidar los porqués, cada uno será libre de actuar de la manera que crea conveniente, aunque aquí se abogue por un uso responsable de las acciones y se ruegue un pensamiento más allá de uno mismo y su presente a la hora de ejecutarlas» (Valero, 2025b).
Bibliografía:
Allaf, M., Elghazaly, H., Mohamed, O. G., Fareen, M. F. K., Zaman, S., Salmasi, A.-M., Tsilidis, K., & Dehghan, A. (2021). Intermittent fasting for the prevention of cardiovascular disease. Cochrane Database of Systematic Reviews, 2021(1), CD013496.
American Diabetes Association Professional Practice Committee. (2024). 5. Facilitating positive health behaviors and well-being to improve health outcomes: Standards of care in diabetes—2024. Diabetes Care, 47(Supplement_1), S77–S110.
American Heart Association. (2024). 8-hour time-restricted eating linked to a 91% higher risk of cardiovascular death. AHA Scientific Sessions 2024, Chicago.
American Society for Preventive Cardiology. (2022). ASPC Clinical Practice Statement on Nutrition, Cardiovascular Health, and the Metabolic Syndrome. American Journal of Preventive Cardiology, 10, 100340.
Antonio, J., Ellerbroek, A., Silver, T., Orris, S., Scheiner, M., Gonzalez, A., & Peacock, C. A. (2015). A high protein diet (3.4 g/kg/d) combined with a heavy resistance training program improves body composition in healthy trained men and women – a follow-up investigation. Journal of the International Society of Sports Nutrition, 12, 39.
Bagherniya, M., Butler, A. E., Barreto, G. E., & Sahebkar, A. (2018). The effect of fasting or calorie restriction on autophagy induction: A review of the literature. Ageing Research Reviews, 47, 183–197.
Belardo, D., Michos, E. D., Blankstein, R., Blumenthal, R. S., Ferdinand, K. C., Hall, K., … & Gulati, M. (2022). Practical, evidence-based approaches to nutritional modifications to reduce atherosclerotic cardiovascular disease: An American Society for Preventive Cardiology Clinical Practice Statement. American Journal of Preventive Cardiology, 10, 100323.
Cardoso, L., et al. (2022). The effects of intermittent fasting on body composition and metabolic health markers in postmenopausal women: A randomized controlled trial. Obesity, 30(1), 123-133.
Catenacci, V. A., Pan, Z., Ostendorf, D., Brannon, S., Gozansky, W. S., Mattson, M. P., Martin, B., MacLean, P. S., Melanson, E. L., & Donahoo, W. T. (2016). A randomized pilot study comparing zero-calorie alternate-day fasting to daily caloric restriction in adults with obesity. Obesity, 24, 1874–1883.
Che, T., Yan, C., Tian, D., Zhang, X., Liu, X., & Wu, Z. (2024). Time-restricted feeding and circadian rhythms: Current progress and future perspectives. Food Science & Nutrition, 12(5), 2989–3002.
Chen, Y.-E., Tsai, H.-L., Tu, Y.-K., & Chen, L.-W. (2024). Intermittent fasting and cardiometabolic health outcomes: An umbrella review and network meta-analysis of randomised controlled trials. BMC Medicine.
Clayton, D. J., & James, L. J. (2016). The effect of breakfast on appetite regulation, energy balance and exercise performance. Proceedings of the Nutrition Society, 75(3), 319–327.
Devries, M. C., Sithamparapillai, A., Brimble, K. S., Banfield, L., Morton, R. W., & Phillips, S. M. (2018). Changes in kidney function do not differ between healthy adults consuming higher- compared with lower- or normal-protein diets: A systematic review and meta-analysis. The Journal of Nutrition, 148(11), 1760–1775.
Diether, N. E., & Willing, B. P. (2019). Microbial fermentation of dietary protein: An ecological perspective. Frontiers in Microbiology, 10, 58.
Hshieh, T. T., Tchang, B. G., & Aronne, L. J. (2025). Longer-term effects of intermittent fasting on body composition and cardiometabolic health in adults with overweight and obesity: A systematic review and meta-analysis. Obesity Reviews, 26(2), e13855.
Iwakiri, K., Kinoshita, Y., Habu, Y., Oshima, T., Manabe, N., … & Fujimoto, K. (2016). Evidence-based clinical practice guidelines for gastroesophageal reflux disease 2015. Journal of Gastroenterology, 51(8), 751–767.
Jamshed, H., Beyl, R. A., Della Manna, D. L., Yang, E. S., Ravussin, E., & Peterson, C. M. (2019). Early time-restricted feeding improves 24-hour glucose levels and affects markers of the circadian clock, aging, and autophagy in humans. Nutrients, 11(6), 1234.
Ko, G. J., Rhee, C. M., Kalantar-Zadeh, K., & Joshi, S. (2020). The effects of high-protein diets on kidney health and longevity. Journal of the American Society of Nephrology, 31(8), 1667–1679.
Lichtenstein, A. H., Appel, L. J., Vadiveloo, M., Hu, F. B., Kris-Etherton, P. M., Rebholz, C. M., … American Heart Association. (2021). Dietary guidance to improve cardiovascular health. (Declaración científica; mención explícita de evidencia insuficiente para ayuno intermitente).
Liu, D., Huang, Y., Huang, C., Yang, S., Wei, X., … & Zhang, H. (2022). Calorie restriction with or without time-restricted eating in patients with obesity. The New England Journal of Medicine, 386(16), 1495–1504.
Lowe, D. A., Wu, N., Rohdin-Bibby, L., Moore, A. H., Kelly, N., Liu, Y. E., … & Vittinghoff, E. (2020). Effects of time-restricted eating on weight loss and other metabolic parameters in women and men with overweight and obesity: The TREAT randomized clinical trial. JAMA Internal Medicine, 180(11), 1491-1499.
Martens, C. R.; …et al. (2020). Short-term time-restricted feeding is safe and feasible in non-obese healthy midlife and older adults. Geroscience, 42(2), 667–686.
Mizushima, N., & Levine, B. (2020). Autophagy in human diseases. New England Journal of Medicine, 383(16), 1564–1576.
Patikorn, C., Roubal, K., Veettil, S. K., Chandran, V., Pham, T., Lee, Y. Y., … & Chaiyakunapruk, N. (2023). Intermittent fasting and obesity-related health outcomes: An umbrella review of meta-analyses of randomized clinical trials. JAMA Network Open, 4(12), e2139517.
Perreault, L. (2025). Obesity in adults: Dietary therapy. UpToDate. Recuperado el 2 de febrero de 2026.
Rong, S., Snetselaar, L. G., Xu, G., Sun, Y., Liu, B., Wallace, R. B., & Bao, W. (2019). Association of skipping breakfast with cardiovascular and all-cause mortality. Journal of the American College of Cardiology, 73(16), 2025–2032.
Semnani-Azad, Z., Khan, T. A., Chiavaroli, L., Chen, V., Bhatt, H. A., et al. (2025). Intermittent fasting strategies and their effects on body weight and other cardiometabolic risk factors: Systematic review and network meta-analysis of randomised clinical trials. BMJ, 389, e082007.
Siles-Guerrero, V., Romero-Márquez, J. M., García-Pérez, R. N., Novo-Rodríguez, C., Guardia-Baena, J. M., Hayón-Ponce, M., Tenorio-Jiménez, C., López-de-la-Torre-Casares, M., & Muñoz-Garach, A. (2024). Is fasting superior to continuous caloric restriction for weight loss and metabolic outcomes in obese adults? A systematic review and meta-analysis of randomized clinical trials. Nutrients, 16(20), 3533.
Sun, M.-L.; … et al. (2024). Intermittent fasting and health outcomes: An umbrella review of systematic reviews and meta-analyses of randomised controlled trials. EClinicalMedicine, 70, 102519.
Sutton, E. F., Beyl, R., Early, K. S., Cefalu, W. T., Ravussin, E., & Peterson, C. M. (2018). Early time-restricted feeding improves insulin sensitivity, blood pressure, and oxidative stress even without weight loss in men with prediabetes. Cell Metabolism, 27(6), 1212–1221.e3.
Templeman, I., Smith, H. A., Chowdhury, E., & Betts, J. A. (2021). The acute appetite and energy intake responses to breakfast consumption and omission in lean and obese men. The American Journal of Clinical Nutrition, 113(6), 1533–1544.
Trepanowski, J. F., Kroeger, C. M., Barnosky, A., Klempel, M. C., Bhutani, S., Hoddy, K. K., … & Varady, K. A. (2017). Effect of alternate-day fasting on weight loss, weight maintenance, and cardioprotection among metabolically healthy obese adults: A randomized clinical trial. JAMA Internal Medicine, 177(7), 930-938.
Thomas, E. A. T., et al. (2022). Early time restricted eating compared to daily caloric restriction: A randomized trial in adults with obesity. (Ensayo 39 semanas; declaración explícita de no conflicto).
Trommelen, J., van Lieshout, G. A. A., Nyakayiru, J., Holwerda, A. M., Smeets, J. S. J., Hendriks, F. K., … & van Loon, L. J. C. (2023). The anabolic response to protein ingestion during recovery from exercise has no upper limit in magnitude and duration in vivo in humans. Cell Reports Medicine, 4(12), 101324.
Valero, A (2025a). El arte de cuidar de nuestro cuerpo. Ediciones Agoeiro.
Valero, A (2025b). El arte de cuidar la mente. McGraw Hill – AULAMAGNA.
Varady, K. A., Cienfuegos, S., Ezpeleta, M., & Gabel, K. (2022). Clinical application of intermittent fasting for weight loss: progress and future directions. Nature Reviews Endocrinology, 18(5), 309–321.
Wang, Y., Zhang, H., & Liu, X. (2025). Efficacy of time restricted eating and resistance training on body composition and mood profiles among young adults with overweight/obesity: a randomized controlled trial. Journal of the International Society of Sports Nutrition, 22(1), 1–15.
Xie, Z., Sun, Y., Ye, Y., Hu, D., Zhang, H., He, Z., Zhao, H., Yang, H., & Mao, Y. (2022). Randomized controlled trial for time-restricted eating in healthy volunteers without obesity. Nature Communications, 13(1), 1003.
Yao, C. K., Muir, J. G., & Gibson, P. R. (2016). Review article: Insights into colonic protein fermentation, its modulation and potential health implications. Alimentary Pharmacology & Therapeutics, 43(2), 181–196.
Zhong, V. W., et al. (2024). Association of 8-hour time-restricted eating with all-cause and cause-specific mortality [Abstract P192]. Circulation, 149(Suppl_1).
Zhou, X., et al. (2024). Effects of DASH diet with or without time-restricted eating in the management of stage 1 primary hypertension: A randomized controlled trial. Nutrition Journal, 23, 65.

[1] No es baladí señalar que esa tendencia a exaltar o demonizar el ayuno intermitente también alcanza a personas que no disponen de conocimientos suficientes para sostener una opinión verdaderamente fundamentada y, por tanto, válida. Nada de ello resulta extraño en un contexto social donde la opinión adquiere peso por el mero hecho de enunciarse, y no por la solidez argumental que la respalda, como ocurre en tantos otros ámbitos.
[2] Una revisión de paraguas o umbrella review es un resumen de resúmenes que junta los resultados de múltiples revisiones científicas para ofrecer una visión global sobre un tema médico o de salud.
[3] Como estudios animales y cultivos celulares.
[4] Metodológicamente, se plantea una revisión estructurada de la literatura científica en humanos, con búsqueda sistemática en bases biomédicas de referencia, aplicación de criterios explícitos de inclusión y exclusión (diseño del estudio, población, tipo de intervención, comparadores, duración y desenlaces), evaluación de calidad metodológica y riesgo de sesgo, y síntesis narrativa-crítica de resultados, diferenciando de manera estricta entre cambios en marcadores intermedios y evidencia sobre desenlaces clínicos, con el fin de ofrecer conclusiones útiles, prudentes y aplicables a la práctica clínica y a la toma de decisiones individualizadas.
[5] De El arte de cuidar de nuestro cuerpo (Valero, 2025a) extraemos que «la obsesión por la salud supone en sí misma una conducta insana», a lo que añadiremos una frase de El arte de cuidar la mente (Valero, 2025b), puesto que viene muy a colación con lo anterior: «el miedo a la enfermedad supone en sí un trastorno cuando la necesidad de salud crea una enfermedad».
[6] Veremos que este es uno de los sesgos comparativos más frecuentes: enfrentar una dieta estructurada en torno al ayuno intermitente —con ventanas de alimentación definidas y criterios de calidad dietética— a otra sin patrón dietético saludable, sin control nutricional y, por tanto, metodológicamente no equivalente.
[7] Como DASH o Mediterráneo, siempre con el incondicional sufijo de “bien entendidos y ejecutados”.
[8] Aun a riesgo —comprensible— de merecer la célebre frase «yo he venido aquí a hablar de mi libro», conviene subrayar la primacía de la función musculoesquelética sobre la estética: no se trata solo de desarrollar masa muscular —ni, desde luego, de que sea “grande”—, sino de que sea funcional. De nuevo remito a El arte de cuidar de nuestro cuerpo (Valero, 2025a), donde se esclarecen este y otros aspectos clave, no solo para comprender sus fundamentos, sino también para saber cómo aplicarlos.
[9] No es intención despistar al lector con terminología sino ceñirse a los papers y trabajos consultados y el uso que hacen de tal terminología —de esta manera, el lector conocerá, si decide rebuscar en bases de datos, a qué corresponden estos acrónimos tan frecuentes en publicaciones sobre la temática—. El TRF o Time-Restricted Feeding (como el TRE o Time-Restricted Eating) consiste en comer cada día dentro de una ventana horaria fija (por ejemplo, 8 horas) y ayunar el resto.
[10] Así es cómo se conoce a los fármacos diabéticos orales utilizados para tratar la diabetes mellitus tipo 2.
[11] Fármacos que estimulan la secreción o liberación de otra sustancia en el organismo.
[12] Las hormonas orexigénicas son señales del cuerpo que aumentan el hambre y te empujan a comer.
[13] La grelina acilada es la forma activa de la grelina (una hormona producida sobre todo en el estómago) y su función principal es aumentar el apetito, además de favorecer la liberación de hormona del crecimiento y señalar al organismo un estado de disponibilidad energética baja (por ejemplo, en ayuno).
[14] Es decir: comer varias veces al día (distribución fraccionada) mantiene constantes las hormonas que le dicen a tu cerebro «estoy lleno/no comas más», evitando los picos extremos de hambre.
[15] En fisiología humana, la litogénesis es el conjunto de procesos fisicoquímicos y biológicos que llevan a la formación de cálculos (piedras) en el organismo, especialmente en el aparato urinario. Este proceso conlleva a la formación de piedras mediante otro proceso conocido como diagénesis, una vez que el cálculo se endurece.
[16] Siempre contemplando el mejor escenario, esto es, partiendo de que se ejecuta de manera adecuada y es pautado por un profesional pertinente.

Cómo citar esta publicación:
Valero, A. (2026). Anatomía de un ayuno: más allá de la moda, evidencia clínica y decisiones inteligentes. Alejandro Valero García; disponible en: https://alejandrovalerogarcia.com/anatomia-de-un-ayuno-mas-alla-de-la-moda-evidencia-clinica-y-decisiones-inteligentes/

